“잠자는 암세포”의 셀 사이클이라는 논문을 우연히 읽게 되어 정리해보았습니다. 원래는 cell cycle과 dna repair를 읽을라 하다가… 꽂혀서 한번 읽어보았습니다. primary tumor가 생길 때부터 dormant tumor cell 이 존재하면서 특정 위치(니치)에 잠자고 있다는 사실이 흥미롭네요…
잠자는 암세포 개념
휴면 암세포란 세포주기가 멈춘(G0–G1 arrest 상태) 상태로, 잠복해 있다가 특정 환경 변화나 자극이 생기면 다시 증식하여 전이가 일어나는 암세포를 말합니다.
대부분의 전이성 암은 ‘일찍’ 전이된 세포가 체내 어딘가에 숨어 있다가 늦게 발현(재활성화)되어 발견된다. 따라서 휴면 암세포가 어떻게 유지되고 깨워지는지를 이해하는 것은 재발과 전이를 막는 핵심 과제입니다.
휴면 암세포의 발생 과정과 역사적 배경
과거 연구(예: 1934년 Willis 연구)에서 이미 암세포가 매우 오랜 기간 대기(dormant)하다가 재발을 일으킬 수 있다는 사실이 제기되었습니다.
뒤이은 연구에서 암세포 휴면과 종양량은 별개의 현상이라는 점(즉, 암 덩어리가 아닌 개별 세포가 휴면 상태를 유지한다는 점)이 강조되었고, 이를 일관되게 정의하는 합의된 용어가 필요해서 탄생하게 되었습니다.
잠자는 암세포 모델
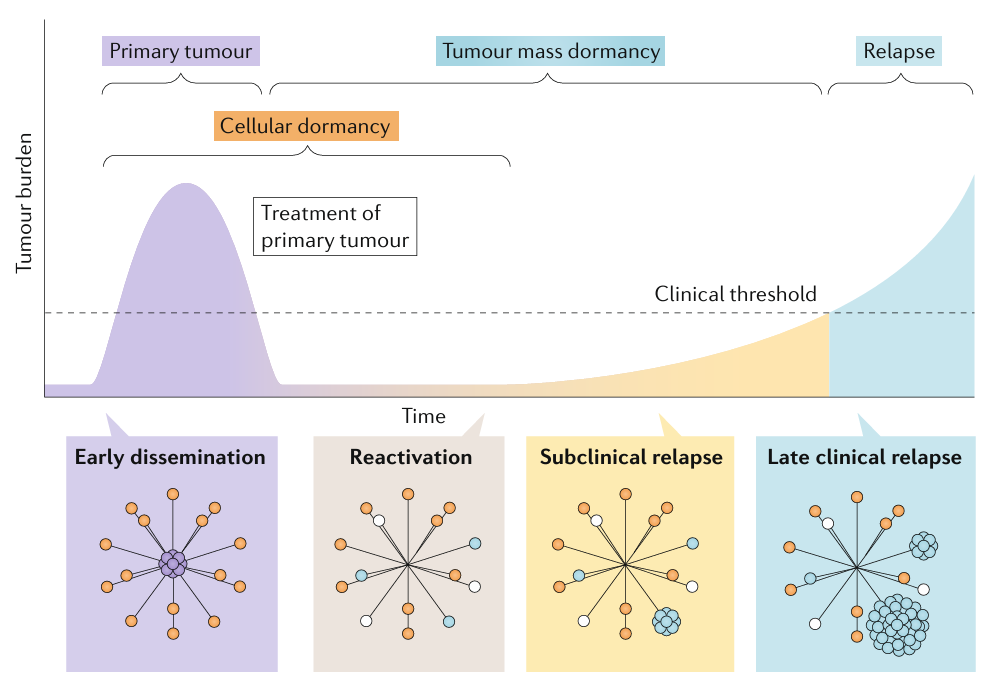
tumour burden을 시간에 따라 나타낸 그래프로 나타냈습니다.
일반적 통념과 달리 휴면 암세포(주황색 원)가 primary tumor(보라색 원)가 임상적으로 검출되기 훨씬 이전 시점부터 이미 전이될 수 있음을 보여줍니다.
따라서 원격 부위에 존재하는 암세포의 세포성 휴면(cellular dormancy)은 primary 종양을 치료하기도 전에 시작됩니다.
그러다 특정 시점에 소수의 휴면 암세포(파란색 원)가 재활성화되어, 임상적 threshold을 넘어서기 전까지 subclinical 성장 과정을 거친 뒤 뒤늦게 전이성 재발로 검출될 수 있습니다.
이 subclinical 단계에서는 휴면 암세포와 종양 덩어리 수준의 휴면(tumour mass dormancy)이 동시에 공존할 수 있습니다.
휴면 암세포와 암줄기세포의 차이
암줄기세포(cancer stem cell)는 ‘느리지만 지속적으로’ 분열을 반복하며, 자기재생(self-renewal) 능력을 갖춥니다.
휴면 암세포는 세포주기를 완전히 멈춘 상태(G0–G1)로 지내다가 재활성화 시점에서 다시 분열을 시작할 수 있습니다.
일부는 암줄기세포와 중첩된 특성을 지닐 수 있지만, 본질적으로 두 개념은 다르다고 논문에서는 강조합니다.
휴면 암세포 연구의 어려움과 최신 기술
- 추적 및 검출 난이도: 휴면 암세포는 극히 희소하며, 신체 여러 곳(예: 골수, 폐, 뇌 등)에 퍼져 있습니다.
- 새로운 툴:
- 형광 및 생체발광 레이블링(예: mVenus-표지 단백질, lipophilic dye)을 이용해 세포분열이 이뤄지지 않는 세포를 “라벨 유지(label-retaining)” 방식으로 추적합니다.
- Intravital microscopy(생체 내 이미징)와 결합해, 휴면 상태 암세포가 실제 조직 내에서 어떻게 움직이고 유지되는지 관찰할 수 있게 되었습니다.
- single cell RNA 시퀀싱 기법으로, 휴면 암세포만의 특징적인 유전자 발현 패턴을 파악합니다.
휴면 암세포가 자리 잡는 니치와 환경
- 암세포가 혈류를 통해 이동하더라도 실제로 정착하는 부위(골수, 폐 등)는 제한적입니다. 이처럼 암세포가 정착하여 휴면 상태로 머물 수 있도록 만드는 특수 미세환경을 “니치(niche)”라고 합니다.
- 니치 예시
- 뼈(골수) 안쪽면인 엔도스틸(endosteal) 표면 근처에는 골아세포(osteoblast) 전구 세포, 혈관, 면역세포 등이 복잡하게 상호 작용하며 암세포 휴면에 관여합니다.
- 폐의 경우는 혈관 주변(perivascular) 영역이 휴면 암세포가 자주 머무는 대표적 니치로 제시됩니다.

잠자는 암세포 주요 특징
논문에서는 휴면 암세포가 갖추어야 할 여섯 가지 특징을 제시합니다.
- 니치 의존성: 특정 환경(니치)에 자리 잡고 해당 미세환경 요소와 지속적으로 상호 작용함.
- 세포주기 정지(G0–G1 arrest): 분열이 멈춰 있으므로 흔히 사용되는 항암제(세포 분열 억제형)에 내성이 있을 가능성이 높음.
- 약물 저항성: 비활성 상태인 탓에 세포분열을 막는 전통적 항암제만으로는 완전히 제거하기 어려움.
- 면역 회피(Immune cloaking): 자신을 면역세포가 잘 알아채지 못하게 조절하여 오래 살아남음. 예를 들어 일부 휴면 암세포는 MHC II 발현을 오히려 높여 T세포나 NK세포의 예리한 감시를 피함
- 재활성화(reactivation): 일정 자극(골수나 혈관의 변화, 염증, 면역 억제 등)에 의해 다시 분열을 시작해 전이성 종양이 생김.
- 가역성(reversibility): 휴면 상태와 증식 상태를 오갈 수 있는 유연한 성질을 보여줌
휴면 암세포가 유지되는 단계적 과정
아래 그림은 암세포가 몸속 니치에 정착해 휴면 상태가 되고, 이후 다시 깨어나는 주요 단계를 개략적으로 보여줍니다.
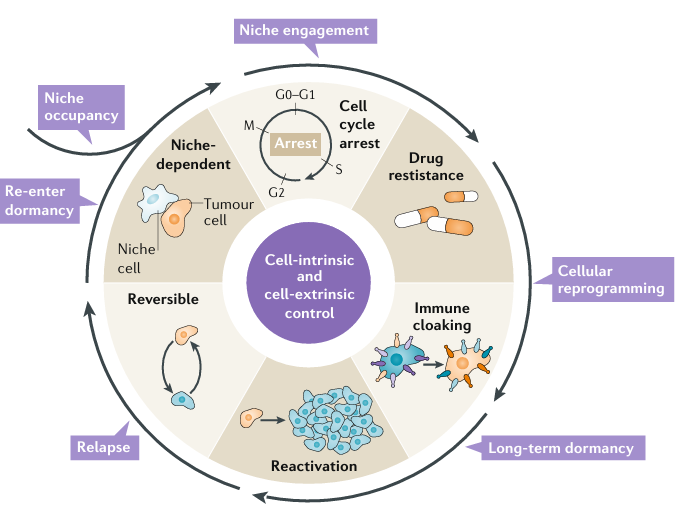
- 니치 점유: 암세포가 골수, 폐 등 특정 조직에 혈류를 통해 도달하고, 그곳의 미세환경에 정착한다.
- 니치와의 상호작용: 골아세포나 혈관내피세포 등과 물리적·화학적으로 접촉하며, 휴면 유도 신호를 주고받는다(예: AXL–GAS6 상호작용).
- 세포 재프로그래밍: 니치 환경에 적응하기 위해 유전자 발현이 변한다. 단일세포 RNA 시퀀싱으로, 휴면 암세포는 면역 관련 유전자를 특이적으로 발현하는 등 독특한 전사체 특징을 나타내는 것이 확인됨.
- 장기 휴면: 면역회피 기작(예: 면역 ‘클로킹’)을 통해 장시간 살아남는다.
- 재활성화: 염증, 조골세포/파골세포 변동, 혈관 리모델링, 면역체계 약화, 특정 인테그린 신호 변화 등으로 인해 세포가 다시 분열을 시작한다.
임상 적용을 위한 타깃 전략
- 니치 점유 차단 또는 이탈 유도
- 니치와 암세포의 상호작용 억제
- 휴면 암세포의 면역 ‘클로킹’ 해제
- 재활성화 억제
- 휴면 상태 지속 유도
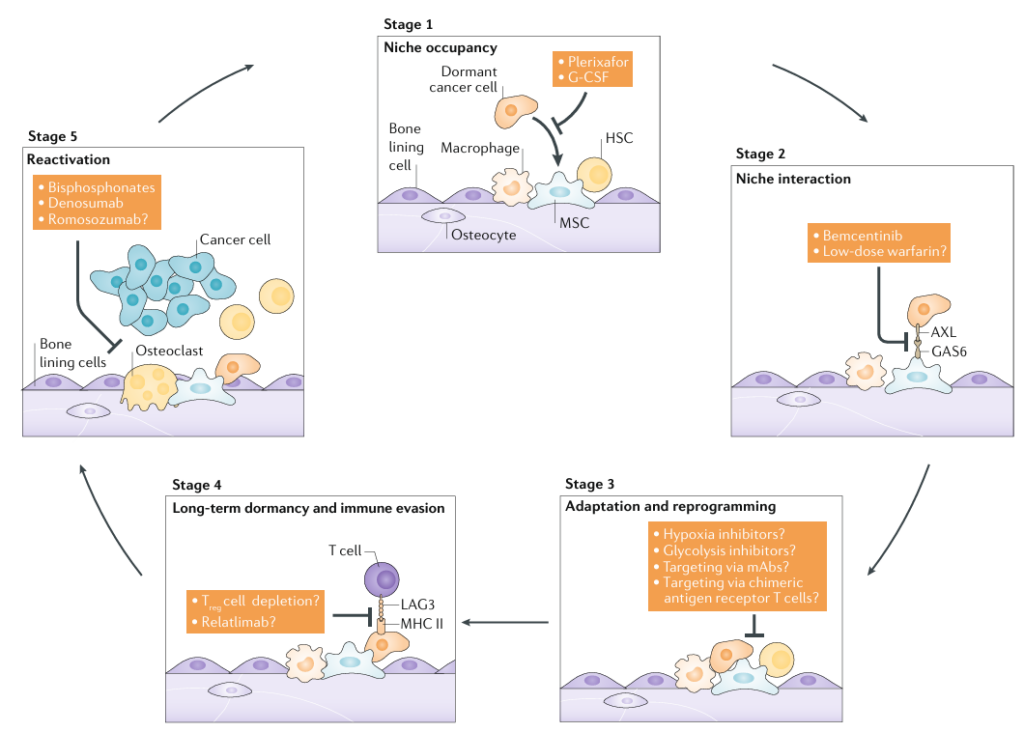
휴면 암세포 라이프 사이클 각 단계(니치 점유→니치 상호작용→재프로그래밍→면역 회피→재활성화)를 겨냥해 개발 중인 다양한 치료 타깃들이 있습니다.
참고한 논문
Nat Rev Cancer. 2020 Jul;20(7):398-411. doi: 10.1038/s41568-020-0263-0. Epub 2020 Jun 2.
